天然に存在する炭素原子は、12C, 13C, 14C があります。このように、原子番号が同じで、質量数の異なる原子を互いに同位体(アイソトープ)といいます。このうち、14C は放射線を放出します。このような原子を放射性同位体(ラジオアイソトープ)といいます。一般に、放射性同位体は原子核が不安定であるため、放射線を出して他の原子に変化します。このことを、崩壊または壊変(物理では崩壊、化学では壊変という表現のようです)といいます。
例えば、12C は \(\beta\) 壊変で 14N に変化します。
放射性同位体は医療や農業といった広い分野で利用されています。ここで、放射性同位体を用いた生存年代の測定を紹介します。
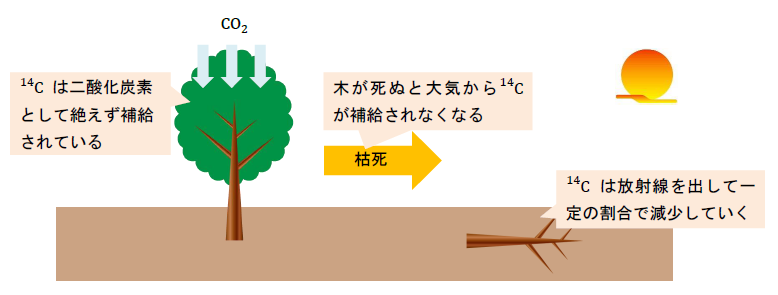
大気中の14Cは、光合成によって二酸化炭素CO2として木に取り込まれるため、木に存在する14Cは大気中と同じ割合に保たれます。
しかし、気が伐採されたり枯れたりすると14Cが大気から補給されなくなるため、壊変によって木の14Cは減少していきます。
14Cの半減期は5730年なので、遺跡から出土した木片に残存している14Cの割合を測定することで、木が生存していた年代を知ることができます。
これを放射性炭素年代測定といいます。
例えば、遺跡から出土した木片の14Cの割合を測定したところ、現在の14Cの割合の \(\frac{1}{16}\) であったとします。
この場合、1 ⇒ \(\frac{1}{2}\) ⇒ \(\frac{1}{4}\) ⇒ \(\frac{1}{8}\) ⇒ \(\frac{1}{16}\) つまり、5730年×4=22920年となり木片は22920年前のものと考えることができます。
例題
遺跡から出土した木片の14Cの割合を測定したところ、現在の14Cの割合の \(\frac{1}{10}\) であったとします。木片は何年前のものと考えられるか。 \(\log_{2} 10 =3.32\) として算出しなさい。
【解答】
14Cの残存量Nは、最初の量をN0とすると
\(N=N_{0}\left( \frac{1}{2} \right)^{\frac{t}{5730}}\)
と表せる。
\(N=\frac{1}{10}\), \(N_{0}=1\)
を代入すると
\(\frac{1}{10}=\left( \frac{1}{2} \right)^{\frac{t}{5730}}\)
\(2^{\frac{t}{5730}}=10\)
\(\frac{t}{5730}=\log_{2} 10\)